? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 中美為何對(duì)瑞德西韋結(jié)論相反 曹彬:中國指標(biāo)更嚴(yán)格
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 2020-4-29? ?青野天潤
柳葉刀:瑞德西韋治療新冠中國重癥患者無顯著療效
靴子落地�����。
4月29日,頂尖醫(yī)學(xué)雜志《柳葉刀》在線正式發(fā)表了瑞德西韋第一項(xiàng)臨床試驗(yàn)的數(shù)據(jù)結(jié)果���。這是一項(xiàng)在中國湖北十家醫(yī)院開展的,針對(duì)重癥新冠肺炎(COVID-19)患者的隨機(jī)���、雙盲���、安慰劑對(duì)照的多中心試驗(yàn)��。
簡(jiǎn)言之�����,這項(xiàng)臨床試驗(yàn)結(jié)果顯示,與安慰劑相比�,接受瑞德西韋給藥治療并沒有顯著提高新冠肺炎患者的臨床改善時(shí)間、死亡率或病毒清除時(shí)間�。
換句話說,瑞德西韋的療效不明顯��。
同日�����,吉利德和美國國立衛(wèi)生研究院則同時(shí)發(fā)布公告稱其臨床試驗(yàn)顯示瑞德西韋顯示出積極的效果��,且已達(dá)到其主要終點(diǎn)�����。接受瑞德西韋治療的晚期患者康復(fù)速度快于接受安慰劑的患者。
?

由于新冠肺炎至今沒有特效藥物���,疫苗仍在路上���,從1月末2月初開始的這場(chǎng)關(guān)于瑞德西韋有沒有效果的討論幾乎周周上熱門?�;仡櫼幌氯鸬挛黜f“成名史”�,結(jié)果還是要靠嚴(yán)格的臨床試驗(yàn)數(shù)據(jù)說話。
“成名史”
瑞德西韋(Remdesivir)是一種核苷酸類似物����,一開始是吉利德公司針對(duì)埃博拉病毒開發(fā)的,但它對(duì)埃博拉的作用不明顯�����。由于在體外和體內(nèi)動(dòng)物模型中證明了對(duì)SARS和MERS等病毒病原體均有活性�,研究人員推測(cè)它對(duì)于此次的新冠肺炎也有效。
2020年1月19日�,一名由武漢返美的35歲男子在華盛頓州確診為新冠肺炎,后醫(yī)生采用“同情用藥”的方式對(duì)其注射了瑞德西韋��,這名男子的臨床狀況得到大幅改善���,瑞德西韋“一戰(zhàn)成名”�。
當(dāng)時(shí)正是中國疫情焦灼的時(shí)期,中國的研究人員立即著手在武漢開展瑞德西韋針對(duì)新冠肺炎的臨床試驗(yàn)��。2月2日��,中日友好醫(yī)院發(fā)布公告稱:“中日友好醫(yī)院在武漢疫區(qū)牽頭開展瑞德西韋(Remdesivir)治療2019-nCoV新型冠狀病毒臨床研究����,為抗擊疫情帶來曙光?���!?/span>
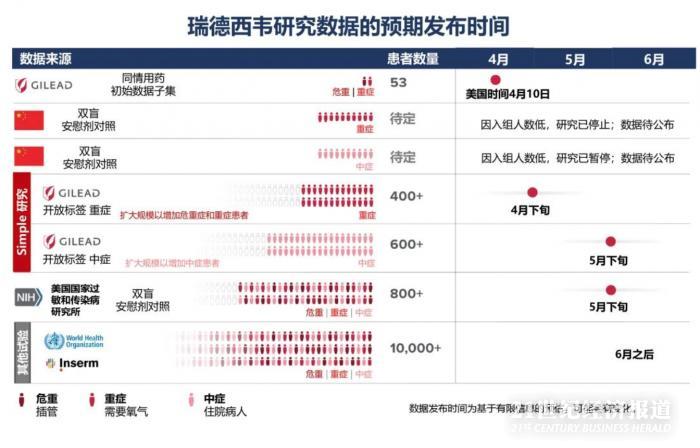
中日友好醫(yī)院呼吸與危重癥醫(yī)學(xué)科主任曹彬團(tuán)隊(duì)在武漢發(fā)起了兩項(xiàng)試驗(yàn)���,根據(jù)ClinicalTrials.gov注冊(cè)信息顯示����,針對(duì)重癥和輕中癥的兩項(xiàng)試驗(yàn)注冊(cè)日期分別為2月6日和2月5日���。其時(shí)預(yù)期結(jié)束時(shí)間為4月底���。
隨著疫情在全球的擴(kuò)散,瑞德西韋相繼在美國和全球其他疫情嚴(yán)重的國家展開臨床試驗(yàn),其中既有研究者發(fā)起�����,也有吉利德自己發(fā)起的臨床試驗(yàn)���。
在全球翹首以盼瑞德西韋“揭盲”的時(shí)候�����,4月10日����,針對(duì)瑞德西韋在全球的進(jìn)展��,吉利德科學(xué)董事長(zhǎng)兼首席執(zhí)行官Daniel O’Day發(fā)布了一封公開信��,稱目前瑞德西韋有七項(xiàng)臨床試驗(yàn)已經(jīng)啟動(dòng)����,預(yù)計(jì)在4月底獲得瑞德西韋針對(duì)重癥患者研究的初步數(shù)據(jù),但在中國“因入組停滯����,針對(duì)重癥患者的研究已停止�����?!?/span>
同時(shí)吉利德在《新英格蘭醫(yī)學(xué)雜志》上發(fā)布一項(xiàng)瑞德西韋(remdesivir)針對(duì)重癥新冠病毒肺炎患者采用同情用藥(compassionate use)的治療結(jié)果���。在接受同情使用瑞德西韋治療的嚴(yán)重Covid-19住院患者中���,在總共53例患者中,有36例(68%)觀察到臨床改善���。但缺乏對(duì)照組試驗(yàn)�����,數(shù)據(jù)存在局限性。
4月15日����,曹彬團(tuán)隊(duì)更新了這兩項(xiàng)試驗(yàn)在全球最大的臨床試驗(yàn)登記中心上的信息,重癥狀態(tài)更新為“終止”���,輕中癥狀態(tài)更新為“暫?��!?����,理由均為“COVID-19的流行在中國已經(jīng)得到很好的控制���,目前沒有符合條件的患者可以被納入?����!?/span>
由于瑞德西韋被寄予厚望����,吉利德市值在2020年一季度上漲14.5%,股價(jià)觸及新高���。
戲劇性始于一周前的4月23日��,由于世衛(wèi)組織的一次“誤操作”讓中國臨床試驗(yàn)結(jié)果提前意外曝光��,稱其療效令人失望�,本來走勢(shì)良好的吉利德當(dāng)天股價(jià)盤中突然跳水����,一度下探超過8%�����,收跌4.34%�����。
這項(xiàng)試驗(yàn)即為此次《柳葉刀》發(fā)布的結(jié)果�����。當(dāng)天吉利德全球首席醫(yī)療官M(fèi)erdad Parsey代表公司緊急發(fā)布聲明稱����,“我們認(rèn)為那篇文章包含了對(duì)研究的不恰當(dāng)描述���。由于入組率低�����,該研究被提前終止,因此����,它的數(shù)據(jù)不足以支撐有統(tǒng)計(jì)意義的結(jié)論���。”
一周后�,《柳葉刀》發(fā)布了曹彬團(tuán)隊(duì)的“不盡如人意”的試驗(yàn)結(jié)果,而美國國立衛(wèi)生院和吉利德堅(jiān)持稱瑞德西韋仍舊有效果����。
根據(jù)吉利德發(fā)布的時(shí)間表,后續(xù)還有多項(xiàng)臨床試驗(yàn)將公布結(jié)果��。
?
曹彬團(tuán)隊(duì)在中國湖北的十家醫(yī)院進(jìn)行了一項(xiàng)隨機(jī)���、雙盲��、安慰劑對(duì)照的多中心試驗(yàn)��。符合條件的患者是入院后經(jīng)實(shí)驗(yàn)室確診的SARS-CoV-2感染的成年人(≥18歲)���,從癥狀發(fā)作到入組間隔為12天或更短,室內(nèi)空氣或血液中氧飽和度不超過94%�����,動(dòng)脈血氧分壓與吸入氧分壓不超過300 mm Hg的比率,以及放射學(xué)確定的肺炎��。
而后隨機(jī)將患者以2:1的比例隨機(jī)分配給瑞德西韋靜脈注射(第1天200 mg��,然后在第2-10天100 mg�,每日一次輸注),或相同劑量的安慰劑輸注10天���。允許患者同時(shí)使用lopinavir–ritonavir���,干擾素和皮質(zhì)類固醇。
主要臨床終點(diǎn)是隨機(jī)分組后28天內(nèi)達(dá)到臨床改善的時(shí)間���。臨床改善被定義為按六點(diǎn)順序量表將患者的入院狀況降低兩點(diǎn)����,或從醫(yī)院實(shí)時(shí)出院�����,以先到者為準(zhǔn)����。
六點(diǎn)量表如下:死亡= 6;體外膜氧合或機(jī)械通氣入院= 5; 無創(chuàng)通氣或高流量氧氣療法入院= 4�����;氧氣治療入院(但不需要大流量或無創(chuàng)通氣)= 3��;入院但不需要氧氣治療= 2; 并已出院或已達(dá)到出院標(biāo)準(zhǔn)(定義為臨床恢復(fù)即發(fā)熱正常���,呼吸頻率<每分鐘24次呼吸���,室內(nèi)空氣中的外周血氧飽和度> 94%,和咳嗽緩解���,均維持至少72 h)= 1����。
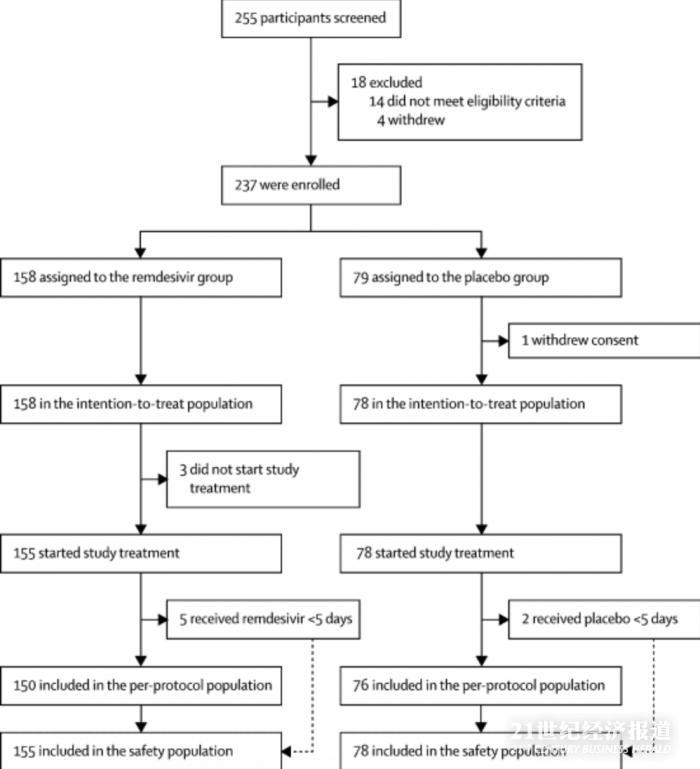
在2020年2月6日至2020年3月12日之間�,篩選了255位患者,其中237位符合條件入組���。158例患者接受了瑞德西韋治療����,79例接受了安慰劑治療。安慰劑組中的一名患者在隨機(jī)分組后撤回了先前書面知情同意書����,因此意向治療患者群(ITT)中包括158名和78名患者。
3月12日之后�,由于武漢市爆發(fā)疫情得到控制,并且沒有根據(jù)方案中指定的終止標(biāo)準(zhǔn)��,因此沒有患者入組�����。數(shù)據(jù)安全和監(jiān)控委員會(huì)建議終止研究���,并于3月29日對(duì)數(shù)據(jù)進(jìn)行分析�。
?
結(jié)果顯示��,使用瑞德西韋與改善臨床療效的時(shí)間無關(guān)(HR=1.23�����, 95% CI�����,0.87-1.75)。兩組的28天死亡率相似(瑞德西韋組22例死亡[14%]安慰劑組為10(13%)�;差1?1%[95%CI -8?1至10?3])�����。但在癥狀持續(xù)時(shí)間為10天或更短的患者中����,接受瑞德西韋治療的患者在臨床上改善的時(shí)間要比接受安慰劑治療的患者快得多(HR=1.52,95% CI��,0.95-2.43)���。
在155名接受瑞德西韋治療的患者有102名(66%)發(fā)生不良事件���,78名安慰劑接受者中有50名(64%)發(fā)生不良事件。瑞德西韋組最常見的不良反應(yīng)是便秘����,低白蛋白血癥,低鉀血癥�����,貧血,血小板減少和總膽紅素升高�。在安慰劑組中,最常見的是低白蛋白血癥�����,便秘��,貧血�,低鉀血癥,天冬氨酸轉(zhuǎn)氨酶升高��,血脂升高和總膽紅素升高�����。
研究人員認(rèn)為����,在這項(xiàng)針對(duì)重度新冠患者住院的成年患者的研究中,瑞德西韋沒有表現(xiàn)出統(tǒng)計(jì)學(xué)上顯著的臨床獲益��。然而��,較早治療者中臨床改善時(shí)間的數(shù)量減少需要更大的研究證實(shí)。
盡管在冠狀病毒感染的臨床前模型中顯示出強(qiáng)大的抗病毒作用����,但在本研究中,瑞德西韋沒有導(dǎo)致SARS-CoV-2 RNA載量或上呼吸道或痰標(biāo)本的可檢測(cè)性顯著降低�����。研究發(fā)現(xiàn)瑞德西韋具有足夠的耐受性�����,未發(fā)現(xiàn)新的安全隱患���。此外,對(duì)于重度新冠患者�,更長(zhǎng)的療程和更高劑量的瑞德西韋是否有益,尚無答案�。
吉利德和NIH的說法
更具有戲劇性的是,4月29日����,吉利德和美國國立衛(wèi)生研究院(NIH)下屬美國國家過敏和傳染病研究所(NIAID)分別發(fā)公告稱其所開展的瑞德西韋臨床試驗(yàn)顯示出積極效果。
吉利德宣布的是一項(xiàng)開放標(biāo)簽的3期SIMPLE試驗(yàn)的主要結(jié)果���,該試驗(yàn)評(píng)估了住院嚴(yán)重COVID-19疾病患者接受瑞德西韋5天和10天給藥時(shí)間的結(jié)果:瑞德西韋5天給藥方案較10天給藥方案顯示出相似的臨床改善�����。并且�����,越早接受瑞德西韋治療的患者臨床改善情況越好(發(fā)病10天內(nèi)和10天后接受治療的患者第14天出院比例分別為62%和49%)���。
NIAID的研究則是一項(xiàng)涉及1063名患者的隨機(jī)對(duì)照試驗(yàn)的初步數(shù)據(jù)分析�����,該試驗(yàn)從2月21日開始�,接受瑞德西韋的新冠肺炎晚期住院患者的康復(fù)速度快于接受安慰劑的類似患者�。
負(fù)責(zé)監(jiān)督試驗(yàn)的獨(dú)立數(shù)據(jù)和安全監(jiān)視委員會(huì)(DSMB)于4月27日舉行會(huì)議,以審查數(shù)據(jù)并與研究小組共享其中期分析結(jié)果����。基于對(duì)數(shù)據(jù)的審查���,他們指出�,從主要終點(diǎn)、恢復(fù)時(shí)間(這是流感試驗(yàn)中常用的一種指標(biāo))的角度來看�����,瑞德西韋優(yōu)于安慰劑���。本研究中的恢復(fù)被定義為足以出院或恢復(fù)正?�;顒?dòng)水平�。
初步結(jié)果表明��,接受瑞德西韋的患者的康復(fù)時(shí)間比接受安慰劑的患者快31%(p <0.001)���。接受瑞德西韋治療的患者的中位恢復(fù)時(shí)間為11天,而接受安慰劑的患者為15天����。結(jié)果還顯示了生存益處,接受瑞德西韋組的死亡率為8.0%��,而安慰劑組的死亡率為11.6%(p = 0.059)���。
受該消息提振���,吉利德當(dāng)日盤中大漲超過8%����,市值過千億美元����。也有華爾街分析師認(rèn)為,F(xiàn)DA可能會(huì)因此加速批準(zhǔn)瑞德西韋上市��。
?

吉利德:瑞德西韋美國試驗(yàn)達(dá)終點(diǎn) 結(jié)果數(shù)據(jù)積極
4月29日���,吉利德官網(wǎng)公布新的關(guān)于瑞德西韋臨床試驗(yàn)結(jié)果���。
吉利德科學(xué)公司關(guān)于美國過敏和傳染病研究所研究抗病毒藥物瑞德西韋用于COVID-19的積極數(shù)據(jù)的聲明。
吉利德了解到來自美國過敏和傳染病研究所(NIAID)對(duì)抗病毒藥物瑞德西韋治療COVID-19的研究得出的積極數(shù)據(jù)��。我們了解該試驗(yàn)已達(dá)到其主要終點(diǎn)���,并且NIAID將在即將舉行的簡(jiǎn)報(bào)中提供詳細(xì)信息��。
Remdesivir尚未在全球任何地方獲得許可或批準(zhǔn)���,并且尚未被證明對(duì)COVID-19的治療是安全或有效的��。吉利德不久后將在該公司的開放標(biāo)簽3期SIMPLE試驗(yàn)中與重度COVID-19疾病患者共享其他remdesivir數(shù)據(jù)��。這項(xiàng)研究將提供信息�����,說明較短的5天治療時(shí)間是否具有與NIAID試驗(yàn)和其他正在進(jìn)行的試驗(yàn)中評(píng)估的10天治療療程相似的療效和安全性�����。吉利德(Gilead)預(yù)計(jì)第二次SIMPLE研究將在5月底評(píng)估中度COVID-19疾病患者的remdesivir的5天和10天給藥時(shí)間���。
吉利德將繼續(xù)與監(jiān)管機(jī)構(gòu)討論有關(guān)瑞德西韋作為COVID-19潛在治療藥物的數(shù)據(jù)集。
?

中美為何對(duì)瑞德西韋結(jié)論相反 曹彬:中國指標(biāo)更嚴(yán)格
VIA:第一財(cái)經(jīng)
權(quán)威醫(yī)學(xué)期刊《柳葉刀》4月29日發(fā)表了全球首項(xiàng)關(guān)于吉利德在研抗病毒藥物瑞德西韋的隨機(jī)雙盲對(duì)照組��、多中心臨床試驗(yàn)論文���,顯示瑞德西韋對(duì)于重癥患者無顯著療效。
權(quán)威醫(yī)學(xué)期刊《柳葉刀》4月29日發(fā)表了由瑞德西韋中國臨床試驗(yàn)負(fù)責(zé)人�、中日友好醫(yī)院副院長(zhǎng)曹彬教授和北京協(xié)和醫(yī)學(xué)院院校長(zhǎng)王辰院士所寫的,關(guān)于全球首項(xiàng)關(guān)于吉利德在研抗病毒藥物瑞德西韋的隨機(jī)雙盲對(duì)照組���、多中心臨床試驗(yàn)論文�����,顯示瑞德西韋對(duì)于重癥患者無顯著療效����。
同一天吉利德科學(xué)公司發(fā)布其針對(duì)397名患者的開放標(biāo)簽臨床III期試驗(yàn)結(jié)果顯示,瑞德西韋早期治療效果顯著���,超過一半患者在兩周內(nèi)出院����。
美國國家過敏與傳染病研究所(NIAID)所長(zhǎng)安東尼?福奇當(dāng)天表示�,瑞德西韋臨床試驗(yàn)數(shù)據(jù)積極,顯著縮短了病人恢復(fù)的時(shí)間��,將成為新冠治療的新標(biāo)準(zhǔn)�����。
針對(duì)中美臨床試驗(yàn)為何出現(xiàn)截然相反的結(jié)果�����,瑞德西韋中國臨床試驗(yàn)負(fù)責(zé)人曹彬教授向第一財(cái)經(jīng)記者獨(dú)家表示,研究終點(diǎn)不同導(dǎo)致了結(jié)果的差異����,中國的研究設(shè)計(jì)更嚴(yán)格。
《柳葉刀》最新發(fā)表的瑞德西韋首項(xiàng)臨床試驗(yàn)論文的通訊作者為中日友好醫(yī)院副院長(zhǎng)曹彬教授和北京協(xié)和醫(yī)學(xué)院院校長(zhǎng)王辰院士����。在對(duì)2月6日至3月12日期間招募的237名來自武漢10家醫(yī)院的重癥患者進(jìn)行臨床試驗(yàn)后,研究作者通過預(yù)先確定的臨床試驗(yàn)主要終點(diǎn)得出結(jié)論����,瑞德西韋用藥與臨床癥狀的改善關(guān)系不大。
從28天死亡率來看��,瑞德西韋組和對(duì)照組分別為14%和13%�;兩組的副作用比例分別為66%和64%。此外���,臨床試驗(yàn)結(jié)果還顯示臨床癥狀改善的風(fēng)險(xiǎn)率(HR)為1.23�。
論文稱��,盡管沒有統(tǒng)計(jì)學(xué)顯著性���,但是根據(jù)預(yù)先確定的次要終點(diǎn)發(fā)現(xiàn),與標(biāo)準(zhǔn)治療的安慰劑組相比,接受瑞德西韋治療的患者在出現(xiàn)癥狀后的10天內(nèi)臨床改善時(shí)間和有創(chuàng)機(jī)械通氣時(shí)間縮短�����。
“次要終點(diǎn)和亞組分析不能改變研究的主要結(jié)論�����?!辈鼙蚪淌谠谡撐陌l(fā)表后對(duì)第一財(cái)經(jīng)記者表示。
曹彬教授向第一財(cái)經(jīng)記者指出��,這是一項(xiàng)設(shè)計(jì)合理的雙盲���、安慰劑對(duì)照��、多中心隨機(jī)試驗(yàn)��。項(xiàng)目執(zhí)行過程非常嚴(yán)格����,極少失訪���。臨床試驗(yàn)結(jié)果表明��,與安慰劑對(duì)照組相比�����,未觀察到瑞德西韋可以加快住院患者的病情恢復(fù)或降低死亡率����。此外,病毒學(xué)方面�,與安慰劑對(duì)照組相比,未觀察到瑞德西韋可更快降低上�����、下呼吸道標(biāo)本中的病毒載量�����。
基于上述結(jié)論�,研究作者認(rèn)為,今后的研究需要確定瑞德西韋在更早期����、更高劑量或與其他抗病毒藥或新冠保護(hù)性抗體聯(lián)合治療重癥患者是否有效。
瑞德西韋中國臨床試驗(yàn)設(shè)計(jì)入組重癥患者453名��,但最終因入組樣本數(shù)量不足,試驗(yàn)于4月16日提前終止�。
《柳葉刀》在發(fā)表瑞德西韋中國臨床試驗(yàn)論文時(shí)�,同時(shí)刊登了一篇由愛丁堡大學(xué)醫(yī)療數(shù)據(jù)主席約翰?諾里(John Norrie)教授撰寫的題為《動(dòng)力不足的臨床研究的挑戰(zhàn)》的評(píng)論文章。
諾里教授指出:“缺乏足夠的臨床試驗(yàn)數(shù)據(jù)的支撐意味著試驗(yàn)的發(fā)現(xiàn)不具有結(jié)論性意義��。但在大流行病的背景下�,數(shù)據(jù)分享尤其重要,能夠快速管理相關(guān)的數(shù)據(jù)集���?����!?/span>
他還強(qiáng)調(diào)�����,高質(zhì)量的隨機(jī)試驗(yàn)的重要性�,認(rèn)為必須嚴(yán)格確認(rèn)或者駁斥觀察性數(shù)據(jù)釋放出的積極信號(hào)����,尤其是在疾病療法的安全性和有效性尚未被驗(yàn)證的情況下。
研究終點(diǎn)不同導(dǎo)致相反結(jié)論
就在《柳葉刀》發(fā)表瑞德西韋中國臨床數(shù)據(jù)的同一天��,4月29日,吉利德科學(xué)公司向外釋放積極信號(hào)����,公布了兩個(gè)好消息,一是來自美國國立衛(wèi)生研究院(NIH)的臨床試驗(yàn)已經(jīng)達(dá)到主要終點(diǎn)�����,并且數(shù)據(jù)正面���;二是公布了吉利德開放標(biāo)簽的臨床試驗(yàn)�,顯示至少一半患者接受治療5天后臨床癥狀改善����、出院,并且接受5天用藥和10天用藥療效相似��。除意大利外��,兩組患者14天死亡率都只有7%����。
?
美國NIH對(duì)全球大約1090名患者展開的隨機(jī)雙盲對(duì)照臨床試驗(yàn)顯示,31%的患者在用藥后癥狀出現(xiàn)改善�。瑞德西韋治療組的恢復(fù)時(shí)間為11天��,對(duì)照組的恢復(fù)時(shí)間是15天����;瑞德西韋組的死亡率是8%�����,對(duì)照組的死亡率是12%���。NIAID所長(zhǎng)福奇承認(rèn),死亡率的改善沒有達(dá)到預(yù)期�。
針對(duì)中美臨床試驗(yàn)的結(jié)論為何出現(xiàn)截然相反的結(jié)果,曹彬教授對(duì)第一財(cái)經(jīng)記者表示:“我們對(duì)用藥時(shí)機(jī)有要求�����,時(shí)間窗口在癥狀出現(xiàn)后的12天以內(nèi)����,但最主要的不同是研究終點(diǎn)的不同,美國NIH的研究終點(diǎn)指標(biāo)過松����。如果我們使用這一指標(biāo)��,估計(jì)也是陰性結(jié)果�?���!?/span>
美國NIH和中國發(fā)表在《柳葉刀》的研究與設(shè)計(jì)均為雙盲安慰劑對(duì)照臨床(RCT),用藥方案相同����。“但是客觀講��,中國瑞德西韋研究設(shè)計(jì)更加嚴(yán)格�����,科學(xué)性更強(qiáng)����。”曹彬教授告訴第一財(cái)經(jīng)記者����。
從主要終點(diǎn)來看,美國NIH設(shè)計(jì)的指標(biāo)為臨床恢復(fù)時(shí)間,中國則是設(shè)計(jì)了基于6分量表的臨床改善時(shí)間�。“NIH的恢復(fù)定義比較寬泛�,包括住院,但不需要氧療����、出院(但可能仍有活動(dòng)受限、需要吸氧)��,相當(dāng)于我們的1-2級(jí)+回家吸氧����?����!辈鼙蚪淌诒硎?���。
前美國FDA局長(zhǎng)斯科特?戈特利布(Scott Gottlieb)表示:“瑞德西韋更像是新冠疾病治療工具箱中的一部分,它不是特效藥�����,但是如果能在患者感染的早期使用,可能會(huì)對(duì)控制疾病的發(fā)展有好處����。”
新冠病毒全球確診感染人數(shù)已經(jīng)超過300萬�,死亡人數(shù)接近22萬。在疫苗研發(fā)結(jié)果仍然需要等待相當(dāng)長(zhǎng)時(shí)間前��,找到有效藥物對(duì)控制疫情是至關(guān)重要的���。
在這樣的背景下��,市場(chǎng)顯然更愿意接受好消息����。受吉利德宣布的臨床試驗(yàn)結(jié)果提振�,4月29日美股開盤后,吉利德在短暫停牌后����,大漲近10%,吉利德近三個(gè)月股價(jià)漲幅超過30%��。